近日,365体育官网_365体育备用【手机在线】中药学院孔令义/张超团队在学科顶尖期刊Molecular Cancer在线发表了题为“The incorporation of acetylated LAP-TGF-β1 proteins into exosomes promotes TNBC cell dissemination in lung micro-metastasis”的最新研究成果。中药学院博士后余培、2019级硕士毕业生韩玉豹为本文共同第一作者,孔令义教授和张超副研究员为本文共同通讯作者,中国药科大学为本文第一通讯单位。
三阴性乳腺癌(TNBC)是复发率和死亡率最高的乳腺癌亚型,肺部是其常见的转移部位。大量证据表明,TNBC在肺部的转移经常以TNBC肺部微转移灶细胞的重复扩散形成(由一变多),而不是直接来源于乳腺癌原发部位的肿瘤细胞的多次转移。TNBC肺部微转移性肿瘤灶能够通过改变血管微环境为大量肺转移性肿瘤灶的形成提供有利的“土壤”。外泌体是细胞间通讯的重要介质之一,肿瘤来源外泌体的“分子货物”(包括蛋白质和核酸)可以调节细胞行为,但TNBC外泌体的“分子货物”是如何影响血管微环境并促进肺部大量转移性肿瘤灶形成的分子细节仍然难以捉摸。
本研究揭示了TNBC外泌体负载LAP-TGF-β1在重塑肺血管生态位,促进TNBC肺转移中的关键作用。尽管各种阻断TGF-β信号通路的策略已经开发出来并取得了临床进展,但其严重的副作用限制了其临床应用。本研究发现,在肺转移部位,TNBC外泌体上的LAP-TGF-β1可以在远低于游离型TGF-β1的剂量下显著重塑肺血管生态位,促进TNBC细胞在肺部的外渗和定植。进一步的研究发现在LAP-TGF-β1的TGFB1区域存在一个非经典的KFERQ样序列,其K304位点会发生乙酰转移酶TIP60介导的乙酰化,促进与HSP90A的相互作用而转运至外泌体。同时抑制HSP90A和TIP60可显著降低LAP-TGF-β1的外泌体负载量,有效抑制TNBC肺转移。该研究不仅为TNBC肺转移的分子基础提供了新的见解,而且为开发新型的治疗策略奠定了基础。
该研究工作得到了国家自然科学基金项目(82304713,82274073)和江苏省卓越博士后计划(2022ZB291)的资助。
全文链接:https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-024-01995-z
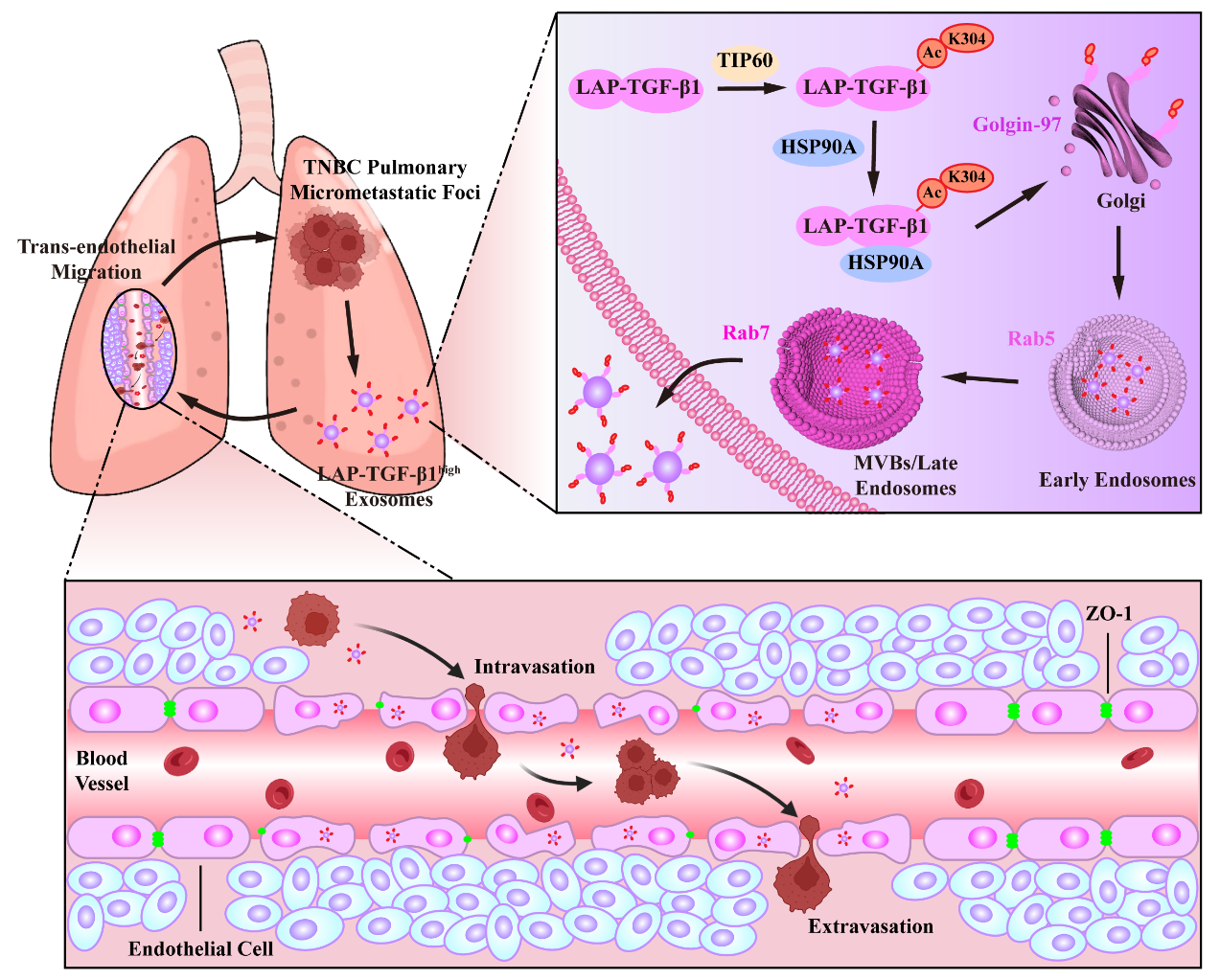
外泌体负载LAP-TGF-β1的机制及其重塑肺血管生态位促进TNBC肺微转移灶扩散的示意图
(供稿单位:中药学院,撰写人:徐文军,审稿人:沈玲玲)





